통합심사·지정, 혁신성 범위 확대, 기술평가 간소화 등 규제개선 착수
혁신의료기기 신청부터 혁신의료기술로 인정받아 의료현장 진입까지의 기간이 기존 390일에서 80일로 대폭 줄어들 것으로 보인다.
보건복지부와 식품의약품안전처는 바이오헬스 산업 혁신방안의 후속조치로 인공지능·빅데이터 기술, 디지털·웨어러블 기술을 활용한 ‘혁신의료기기’가 의료현장에서 신속하게 사용되도록 관련 규제개선에 착수한다고 밝혔다.
통합심사·지정, 혁신성 인정 범위 확대 및 혁신의료기술평가 간소화 등을 위해 관련 법령을 개정하고, 개정이 완료되면 이를 바탕으로 본격적인 운영에 나설 방침이다.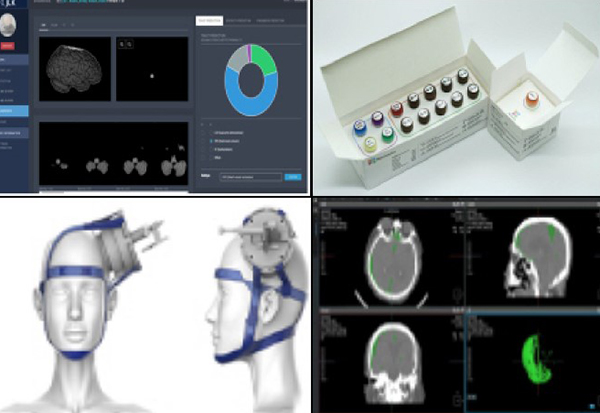
▲ (왼쪽 위부터 시계방향으로)혁신의료기기로 지정된 제이엘케이의 뇌영상검출·진단보조소프트웨어, 노보믹스의 종양관련유전자검사시약, 코어라인소프트의 뇌영상검출·진단보조소프트웨어, 뉴로소나의 집속형초음파 자극시스템
혁신의료기기는 의료기기산업법 제2조에 따라 정보통신·생명공학·로봇 등 기술집약도가 높고 혁신 속도가 빠른 분야의 첨단기술을 가진 의료기기다.
정부는 그동안 심전도분석 진단보조 소프트웨어 등 19개를 혁신의료기기로 지정했는데, 관계자들은 지정 이후 혁신의료기기를 신속하게 임상현장에서 사용할 수 있도록 관련 규제를 개선해달라는 요청을 해왔다.
이에 정부는 혁신의료기기군 내 첨단기술군 중 인공지능·빅데이터 기술과 디지털·웨어러블 기술을 활용한 의료기기로 이미 인허가를 받았거나 혁신의료기기 지정 신청 시 인허가를 동시에 신청하는 의료기기를 대상으로 신속한 현장진입을 위해 규제개선에 나서기로 했다.
먼저 기존에 순차적으로 진행되던 혁신의료기기 지정, 기존기술 여부 확인, 혁신의료기술평가를 통합해 동시에 심사한다.
이 과정으로 혁신의료기기 지정 신청 시 혁신의료기기 신청과 요양급여 대상·비급여대상 판단 신청, 혁신의료기술평가 신청, 인허가 신청이 동시에 이뤄지게 된다.
신청내용 심사 결과 신청된 의료기기에 대해 관계부처와 기관이 혁신성·안전성·유효성 등을 신속하게 평가해 기준을 충족하는 경우 신청 후 30일 안에 혁신의료기기로 지정한다.
나아가 통합심사·지정을 위해 현행 상시접수 방식을 바꿔 일정기간을 정해 공고해서 신청받는 방식으로 변경한다.
또 그동안 대부분 기존기술로 판단좼던 인공지능과 디지털 혁신의료기기를 혁신의료기술평가 대상으로 확대해 분류할 방침이다.
특히 혁신의료기기로 지정된 제품이 잠재적 가치평가 필요성이 있는 경우 혁신의료기술평가 대상으로 분류할 수 있도록 규정을 마련한다.
아울러 산업계 전문가가 참여하는 ‘디지털 소프트웨어 전문평가위원회’를 신설하고 이 위원회는 인공지능·디지털 분야에 특화해 전문적 심사를 제공한다.
이와 함께 혁신의료기술 평가 항목 및 절차를 간소화해 기존에 신청 후 최대 250일이 걸리던 혁신의료기술 평가를 식약처 인허가 기간인 약 80일로 마칠 수 있도록 개선한다.
이를 위해 위원회 심의 과정을 4~5회에서 2회로 최소화하고, 의료행위 영향 등을 중점으로 평가 항목도 14개에서 3개로 간소화 한다.
통합심사·지정제, 혁신성 인정 확대 및 혁신의료기술평가 간소화에 따라 혁신의료기기는 최소한의 행정조치인 고시 30일을 거쳐 비급여 또는 선별급여로 의료현장에서 3년에서 5년까지 사용할 수 있게 된다.
이기일 보건복지부 제2차관은 “기업이 모래주머니를 차고 뛰는 상황을 해소해 일하기 좋은 환경을 만들어 가고 보건의료 분야에서 국민 편익과 국익에 도움이 되도록 규제를 적극적으로 해소해 나갈 것”이라고 말했다.
오유경 식품의약품안전처장은 “혁신의료기기 규제개선이 인공지능, 디지털 기술을 활용한 첨단 의료기기 산업 활성화와 환자의 의료선택권 확대로 이어지기를 기대한다”고 밝혔다.
보건복지부와 식품의약품안전처는 바이오헬스 산업 혁신방안의 후속조치로 인공지능·빅데이터 기술, 디지털·웨어러블 기술을 활용한 ‘혁신의료기기’가 의료현장에서 신속하게 사용되도록 관련 규제개선에 착수한다고 밝혔다.
통합심사·지정, 혁신성 인정 범위 확대 및 혁신의료기술평가 간소화 등을 위해 관련 법령을 개정하고, 개정이 완료되면 이를 바탕으로 본격적인 운영에 나설 방침이다.

혁신의료기기는 의료기기산업법 제2조에 따라 정보통신·생명공학·로봇 등 기술집약도가 높고 혁신 속도가 빠른 분야의 첨단기술을 가진 의료기기다.
정부는 그동안 심전도분석 진단보조 소프트웨어 등 19개를 혁신의료기기로 지정했는데, 관계자들은 지정 이후 혁신의료기기를 신속하게 임상현장에서 사용할 수 있도록 관련 규제를 개선해달라는 요청을 해왔다.
이에 정부는 혁신의료기기군 내 첨단기술군 중 인공지능·빅데이터 기술과 디지털·웨어러블 기술을 활용한 의료기기로 이미 인허가를 받았거나 혁신의료기기 지정 신청 시 인허가를 동시에 신청하는 의료기기를 대상으로 신속한 현장진입을 위해 규제개선에 나서기로 했다.
먼저 기존에 순차적으로 진행되던 혁신의료기기 지정, 기존기술 여부 확인, 혁신의료기술평가를 통합해 동시에 심사한다.
이 과정으로 혁신의료기기 지정 신청 시 혁신의료기기 신청과 요양급여 대상·비급여대상 판단 신청, 혁신의료기술평가 신청, 인허가 신청이 동시에 이뤄지게 된다.
신청내용 심사 결과 신청된 의료기기에 대해 관계부처와 기관이 혁신성·안전성·유효성 등을 신속하게 평가해 기준을 충족하는 경우 신청 후 30일 안에 혁신의료기기로 지정한다.
나아가 통합심사·지정을 위해 현행 상시접수 방식을 바꿔 일정기간을 정해 공고해서 신청받는 방식으로 변경한다.
또 그동안 대부분 기존기술로 판단좼던 인공지능과 디지털 혁신의료기기를 혁신의료기술평가 대상으로 확대해 분류할 방침이다.
특히 혁신의료기기로 지정된 제품이 잠재적 가치평가 필요성이 있는 경우 혁신의료기술평가 대상으로 분류할 수 있도록 규정을 마련한다.
아울러 산업계 전문가가 참여하는 ‘디지털 소프트웨어 전문평가위원회’를 신설하고 이 위원회는 인공지능·디지털 분야에 특화해 전문적 심사를 제공한다.
이와 함께 혁신의료기술 평가 항목 및 절차를 간소화해 기존에 신청 후 최대 250일이 걸리던 혁신의료기술 평가를 식약처 인허가 기간인 약 80일로 마칠 수 있도록 개선한다.
이를 위해 위원회 심의 과정을 4~5회에서 2회로 최소화하고, 의료행위 영향 등을 중점으로 평가 항목도 14개에서 3개로 간소화 한다.
통합심사·지정제, 혁신성 인정 확대 및 혁신의료기술평가 간소화에 따라 혁신의료기기는 최소한의 행정조치인 고시 30일을 거쳐 비급여 또는 선별급여로 의료현장에서 3년에서 5년까지 사용할 수 있게 된다.
이기일 보건복지부 제2차관은 “기업이 모래주머니를 차고 뛰는 상황을 해소해 일하기 좋은 환경을 만들어 가고 보건의료 분야에서 국민 편익과 국익에 도움이 되도록 규제를 적극적으로 해소해 나갈 것”이라고 말했다.
오유경 식품의약품안전처장은 “혁신의료기기 규제개선이 인공지능, 디지털 기술을 활용한 첨단 의료기기 산업 활성화와 환자의 의료선택권 확대로 이어지기를 기대한다”고 밝혔다.
<저작권자 ⓒ 연합국민뉴스, 무단 전재 및 재배포 금지>
진우영 기자 다른기사보기



