식품의약품안전처는 24일 국가출하승인 현황을 투명하게 공개하고 생물학적제제 품질관리시스템의 우수성을 알리기 위해 ‘2021 국가출하승인 연례 보고서’를 발간·배포했다.
이번 보고서에는 지난해 국가출하승인 현황, 코로나19 백신 신속 국가출하승인 현황, 생물학적제제 품질확보 노력, 코로나19 백신 맞춤형 전주기 품질관리 상담제 운영 결과, 관련 규정 제·개정 사항 안내 등이 담겨있다.
식약처는 2010년부터 해마다 보고서를 발간해 국가출하승인 제도와 백신, 혈장분획제제 등의 품질 정보 등을 안내하고 있다.
국가출하승인은 생물학적제제의 제조단위별로 식약처의 검정시험 결과와 제조원의 제조·시험 결과에 대한 자료를 종합적으로 평가해 생물학적제제가 시중에 유통되기 전에 국가가 품질을 한 번 더 확인하는 제도다.
생물학적제제는 생물체에서 유래된 물질이나 생물체를 이용해 생성시킨 물질을 함유한 의약품으로 백신과 혈장분획제제 등이 있다.
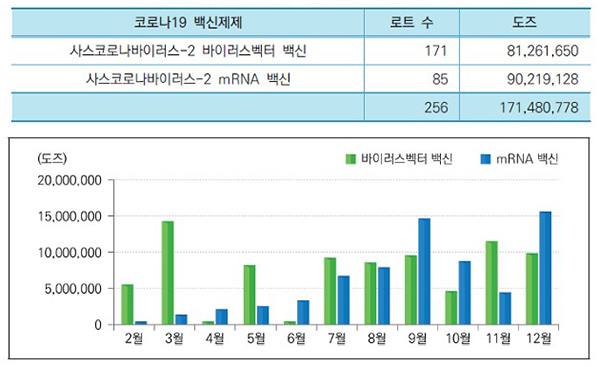
한편 2021년에는 기존 국가출하승인의약품 외에 코로나19 백신을 신속 국가출하승인했다.
지난해 2월 17일 ‘한국아스트라제네카백스제브리아주’를 국내 처음으로 신속 국가출하승인한 후 코로나19 백신은 모두 256로트, 1억 7148만 778도즈를 출하승인했다.
참고로 지난해에는 세균백신 252로트(7573만 9172도즈), 바이러스백신 607로트(1억 722만 4570도즈), 보툴리눔제제 459로트, 혈장분획제제 1000로트도 출하승인했다.
식약처는 “앞으로도 국민이 안심하고 생물학적제제를 사용할 수 있도록 국가출하승인 정보를 투명하게 공개하고 안전성·효과성, 품질이 입증된 제품이 공급될 수 있도록 최선을 다하겠다”고 밝혔다.
이번 보고서의 자세한 내용은 식약처 누리집→ 법령·자료 → 홍보물자료 → 전문홍보물에서 확인할 수 있다.
<저작권자 ⓒ 연합국민뉴스, 무단 전재 및 재배포 금지>
강다원 기자 다른기사보기



